ال المستحث المناسب- تعود النظرية إلى Koshland وتتوافق مع امتداد لمبدأ قفل المفاتيح ، والذي يعتمد على دقة ملاءمة الهياكل التشريحية. يشير التلاؤم المستحث إلى إنزيمات مثل كيناز التي تغير شكلها لتشكيل مركب إنزيم - يجند. في حالة عيوب الإنزيم ، يمكن أن يتأثر مبدأ الملاءمة المستحث بالاضطرابات.
ما هو الاحتواء المستحث؟

تعمل العديد من العمليات في الجسم على مبدأ القفل الرئيسي أو مبدأ اليد في القفاز. هذا ينطبق ، على سبيل المثال ، على الوصلات المفصلية. يتم تثبيت رأس المفصل في مقبس المفصل مثل مفتاح في قفل أو يد في قفاز. يفتح الباب فقط عندما يكون المفتاح في القفل بالضبط. في نفس السياق ، يتم فتح وظائف معينة للجسم فقط عندما تلتقي الهياكل بدقة.
الملاءمة المستحثة هي شكل خاص من مبدأ القفل. هذه نظرية لتكوين معقدات بروتينية ، على سبيل المثال مركب ركيزة إنزيم في سياق تفاعلات محفزة بالإنزيم.
يعتبر دانيال إي كوشلاند أول من وصف النظرية وافترضها لأول مرة في عام 1958. على عكس مبدأ قفل المفتاح ، فإن نظرية الملاءمة المستحثة لا تفترض بنيتين ثابتتين. في حالة مجمعات البروتين - يجند على وجه الخصوص ، يجب أن يؤدي التغيير التوافقي في البروتين المعني إلى تمكين تكوين المركب. يُنظر إلى Ligand والبروتين ، أو بالأحرى إنزيم ، على أنها ديناميكية وتحدث عن تفاعل يحرك كلا الشريكين إلى تغيير في التشكل من أجل تكوين معقد.
الوظيفة والمهمة
هناك خصوصية ملزمة بين الإنزيمات والركائز. هذه الخصوصية الملزمة تعني مبدأ قفل المفاتيح. كل إنزيم له مركز نشط. بالنسبة للتكوين المعقد باستخدام يجند ، يتم تشكيل هذا المركز بدقة بطريقة تتطابق تمامًا مع الشكل المكاني للركيزة المقصودة.
ومع ذلك ، في حالة العديد من الإنزيمات ، يكون المركز النشط في كل حالة في شكل غير دقيق للغاية طالما أنه غير مرتبط بالركيزة. يبدو أن هذه الملاحظة تتعارض مع مبدأ القفل والمفتاح ، لأن الإنزيمات وروابطها يبدو في البداية أنها تتكيف مع شكلها.
بمجرد أن يعلق الإنزيم نفسه على رابطة ، يتم إنشاء تفاعلات بين الجزيئات. تؤدي هذه التفاعلات على مستوى الجزيئات إلى تغيير في شكل الإنزيم. يُفهم أن التشكل يعني الترتيبات المختلفة الممكنة للذرات الفردية في الجزيء والتي تنتج عن دوران بسيط حول محور. يتوافق التغيير في تكوين الإنزيمات مع تغيير في الترتيب المكاني لجزيئاتها ويسمح فقط بتكوين مركب ركيزة إنزيم.
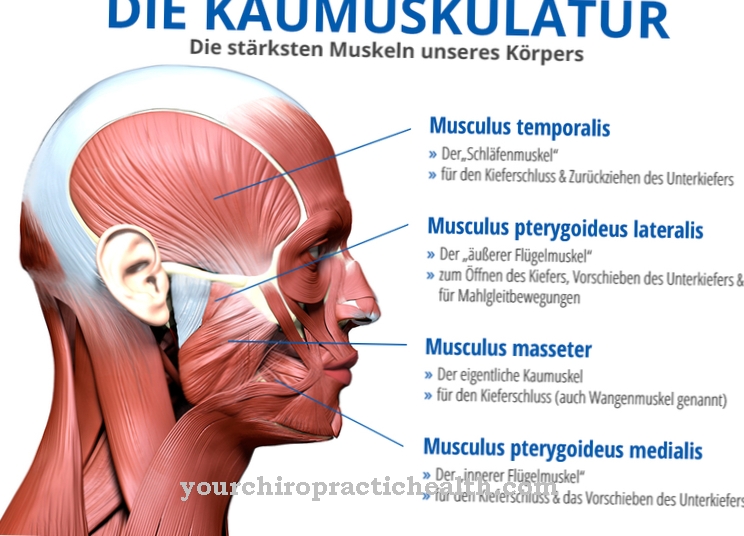
يحفز هيكسوكيناز كإنزيمات ، على سبيل المثال ، الخطوة الأولى من تحلل السكر. حالما تتلامس هذه الإنزيمات مع ركيزة الجلوكوز ، يمكن ملاحظة النوبة المستحثة بمعنى تكوين "النوبة المستحثة". يعمل إنزيم هكسوكيناز على الفسفور لجلوكوز يجند عن طريق استهلاك ATP لتشكيل الجلوكوز 6 فوسفات.
تشبه بنية الماء تلك الموجودة داخل المجموعة الكحولية لذرة C6 ، والتي يقوم الإنزيم بفوسفوريلاتها أثناء التفاعل. نظرًا لصغر حجمها ، يمكن لجزيئات الماء أن تلتصق بالمركز النشط للإنزيم ، بحيث يتم توليد التحلل المائي لـ ATP. ومع ذلك ، فإن الملاءمة المستحثة تسمح للهكسوكيناز بتحفيز تحويل الجلوكوز بخصوصية عالية ، بحيث يجب أن يحدث التحلل المائي لـ ATP إلى حد صغير. مع آلية الملاءمة المستحثة ، تزداد خصوصية الركيزة.
يمكن ملاحظة المبدأ داخل الكائن البشري بشكل خاص في حالة الكينازات. لا ينطبق التكيف المستحث على كل مجمع مستقبلات يجند ، نظرًا لأن التغيير التوافقي لكلا الشريكين هو في كثير من الحالات حدود طبيعية.
الامراض والاعتلالات
ينزعج مبدأ الملاءمة المستحثة في حالة وجود عيوب إنزيمية مختلفة. في بيلة الفينيل كيتون ، على سبيل المثال ، يتم تقييد نشاط الإنزيمات أو تفشل تمامًا. عادة ما يكون هذا بسبب خلل جيني. في بيلة الفينيل كيتون ، يكون إنزيم فينيل ألانين هيدروكسيلاز معيبًا. لم يعد يتحول فينيل ألانين إلى تيروزين ويتراكم وفقًا لذلك. تظهر المواد السامة للأعصاب ، بحيث أنه بالإضافة إلى الإعاقات العقلية ، يميل المريض إلى التشنج. عادة ما تكون عيوب الإنزيم وراثية وتنتج عن تسلسل حمض أميني مشفر بشكل غير صحيح في الحمض النووي.
تُعرف الأمراض الأيضية التي تسببها عيوب الإنزيم ومبدأ الملاءمة المستحث المضطرب باسم اعتلالات الإنزيم. توجد عيوب بيروفات كيناز ، على سبيل المثال ، في جين PKLR المشفر بشكل غير صحيح. يقع هذا الجين في موضع الجين 1q22 للكروموسوم 1. تُعرف الطفرات المختلفة لأليل PKLR لبيروفات كيناز ، والتي تظهر كعيوب في الشكل R.
يشار إلى مرضها مرة أخرى باسم النوع السادس من الجليكوجين وينتمي إلى مجموعة أمراض تخزين الجليكوجين. وهو اضطراب استقلابي متنحي أو مرتبط بالكروموسوم X بسبب عيوب إنزيمية. بتعبير أدق ، يكمن السبب في عيوب إنزيم مختلفة في نظام فسفوريلاز كيناز داخل الكبد والعضلات. المعروف في هذا السياق ، على سبيل المثال ، عيب فسفوريلاز ب-كيناز المرتبط بـ X في الكبد ، وخلل فوسفوريلاز الكبد في الوراثة المتنحية الجسدية والفشل المشترك للفوسفوريلاز ب كيناز داخل الكبد والعضلات.
فيما يتعلق بفوسفوريلاز الكبد ، تم تحديد الطفرات المسببة على جين PYGL وبالتالي فهي موجودة على الكروموسوم 14q21 إلى q22. تم ربط نقص فسفوريلاز عضلة الكبد بطفرات في جين PHKB في الموضع 16q12-q13. تم تحديد الطفرات السببية في جين PHKA2 في الموضع Xp22.2-p22.1 للخلل المرتبط بـ X في كيناز فسفوريلاز الكبد. يمكن لمركبات الجليكوجين الأخرى أن تلغي أيضًا تأثير الملاءمة المستحث للكيناز المقابل أو تجعله أكثر صعوبة.








.jpg)




.jpg)