ال إنتيروبيبتيداز هو إنزيم من الغشاء المخاطي الاثني عشر وظيفته تنشيط إنزيمات البنكرياس. إنه يقف في بداية سلسلة تنشيط كاملة من الإنزيمات الهاضمة. يؤدي الخلل الوظيفي في إنتيروبيبتيداز إلى سوء الهضم وسوء امتصاص الطعام في الأمعاء الدقيقة.
ما هو إنتيروبيبتيداز؟
Enteropeptidase هو إنزيم من الغشاء المخاطي في الاثني عشر ، والذي ينشط الإنزيمات الهضمية للبنكرياس عن طريق تنشيط التربسينوجين إلى التربسين.
يفرز Enteropeptidase في حدود الفرشاة من الغشاء المخاطي للعفج. على وجه التحديد ، فإن غدد ليبيك هي المسؤولة عن الإفراز. غدد ليبيكون هي انخفاضات أنبوبية في ظهارة الأمعاء الدقيقة والكبيرة. في الأمعاء الدقيقة ، تقع بين الزغابات المعوية الدقيقة. تفرز الغدد ، المعروفة أيضًا باسم خبايا ليبيركون ، عددًا كبيرًا من الإنزيمات بالإضافة إلى إنتيروبيبتيداز. يتم تحفيز إفراز إنتيروبيبتيداز عندما يدخل الكيموس ، الذي تم هضمه مسبقًا في المعدة ، إلى الاثني عشر. لا يؤثر الإنزيم وحده على مكونات الغذاء.
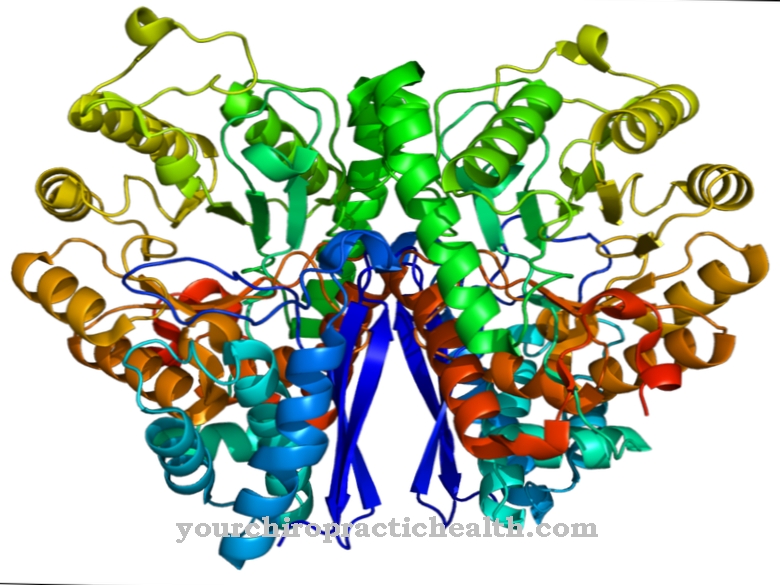
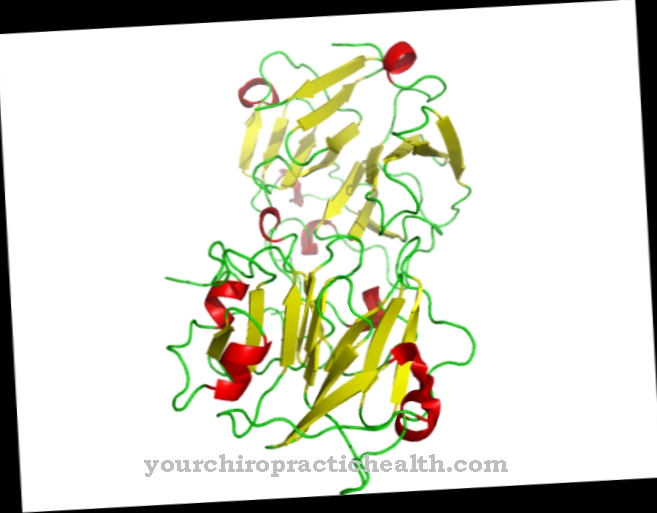
فقط تنشيط إنزيم التربسين يحدد سلسلة التنشيط الكاملة للإنزيمات الهاضمة في الحركة. Enteropeptidase ، مثل التربسين والبروتياز الآخر للبنكرياس ، هو بروتين سيرين. يحتوي المركز النشط على الثالوث الحفاز لحمض الأسبارتيك والحامض الهيستيدين والسيرين. باعتباره إندوبيبتيداز ، فإن إنتيروبيبتيداز يشق البروتينات فقط عند نقاط مميزة معينة مع نماذج تمييز معينة في تسلسل الأحماض الأمينية. ينشق الإنزيم دائمًا عند فكرة التعرف على Asp-Asp-Asp-Asp-Lys. مع التربسينوجين ، يتم شق سداسي الببتيد Val- (Asp) 4-Lys ، مع تكوين التربسين.
الوظيفة والتأثير والمهام
وظيفة إنتيروبيبتيداز هي تنشيط الإنزيمات الهضمية في البنكرياس. يبدأ فقط الخطوة الأولى من التنشيط بتحويل التربسينوجين إلى التربسين.
التربسين هو بدوره بروتين سيرين يشق البروتينات بناءً على نفس خاصية التعرف على الخصائص. يستمر الآن في تنشيط التربسينوجين نفسه. في الوقت نفسه ، ينشط إنزيمات البنكرياس الأخرى من سلائفها مثل كيموتريبسينوجين ، برو-إيلاستاز ، برو كاربوكسي ببتيداز ، برو-فسفوليباز وبروينتيروببتيداز. يكون Enteropeptidase أيضًا مبدئيًا في الشكل الأولي غير النشط. عندما يدخل الكيموس إلى الاثني عشر ، لا يتم إفراز proenteropeptidase فحسب ، بل يتم إفراز أنزيم الاثني عشر أيضًا ، مما ينشط الشكل الأولي من enteropeptidase. بعد بدء سلسلة التنشيط ، يتولى التربسين تنشيط جميع إنزيمات البنكرياس بما في ذلك proenteropeptidase و trypsinogen.
يتم تنشيط proenteropeptidase إلى enteropeptidase بشكل أكثر فعالية من خلال عمل التربسين من خلال الاثني عشر. إن الوجود الأساسي للإنزيمات الهضمية في شكلها الخامل مهم للغاية. عمل البروتياز على وجه الخصوص غير محدد. جميع البروتينات التي تحتوي على نموذج التعرف المميز داخل الجزيء مشقوق مائيًا. إذا كانت الإنزيمات نشطة بشكل تحفيزي على الفور ، فسيتم بالفعل هضم بروتينات الجسم في البنكرياس والقناة البنكرياسية. نتيجة لذلك ، يذوب البنكرياس نفسه. يتم التنشيط فقط في الاثني عشر خارج الغدد الصماء الخارجية.
يمكن أن تبدأ الإنزيمات هنا في تحطيم مكونات الطعام دون مهاجمة أنسجة الجسم. لمنع تنشيط الإنزيمات قبل الأوان ، يعمل مثبط إضافي للتربسين في قناة البنكرياس. ومع ذلك ، فإن الدور الرئيسي للشلال الهضمي يلعبه التربسين. بمجرد تنشيط هذا الإنزيم ، لا يمكن إيقاف تنشيط جميع الإنزيمات الهضمية ، بما في ذلك إنتيروبيبتيداز.
التعليم والوقوع والخصائص والقيم المثلى
مثل كل سيرين بروتياز ، فإن إنتيروبيبتيداز له أيضًا تأثير غير محدد ويشق البروتينات باستخدام نموذج التعرف المميز. يتكون Enteropeptidase من سلسلة خفيفة وثقيلة مرتبطة بجسور ثاني كبريتيد. يقع مجال سيرين بروتياز على السلسلة الخفيفة.
تحتوي السلسلة الثقيلة على كتلة جزيئية من 82 إلى 140 كيلودالتون ، وتتراوح الكتلة الجزيئية للسلسلة الخفيفة من 35 إلى 62 كيلودالتون. هيكل السلسلة الخفيفة من إنتيروبيبتيداز مشابه لبروتياز سيرين الأخرى التربسين وكيموتربسين. السلسلة الثقيلة مرتبطة بالغشاء وتؤثر على خصوصية الإنزيم. وجد أن السلسلة الخفيفة المعزولة لها تأثير مشابه ضد فكرة التعرف على الخصائص - (Asp) 4-Lys- ، ولكن تأثيرها أقل بشكل ملحوظ ضد التربسينوجين.
الأمراض والاضطرابات
يتم ترميز Enteropeptidase البشري بواسطة جين ENTK الموجود على الكروموسوم 21. يمكن أن يؤدي تحور هذا الجين إلى أمراض خطيرة لدى الأطفال المصابين.
لم يعد بإمكان الإنزيم تنشيط الإنزيمات الهضمية الأخرى. لم تعد مكونات الطعام تتفكك وبالتالي لم يعد من الممكن امتصاصها بواسطة الأمعاء الدقيقة. إنها في المقام الأول مسألة سوء الهضم (الانهيار غير الكافي) ، مما يؤدي إلى سوء امتصاص مكونات الغذاء. لم يعد الجسم مزودًا بالعناصر الغذائية بشكل كافٍ. يحدث الفشل في النمو وتوقف النمو والأعراض النموذجية لنقص البروتين مع تطور الوذمة. في الوقت نفسه ، بالإضافة إلى البروتينات ، يتم امتصاص الكربوهيدرات والدهون بشكل سيئ. نظرًا لأن مكونات الطعام غير المهضومة تصل إلى الأمعاء الغليظة وتتحلل هناك عن طريق التخمر والبكتيريا المتعفنة ، يحدث انتفاخ البطن والإسهال وآلام البطن.
حتى الآن ، تم وصف 15 حالة من حالات نقص إنتيروبيبتيداز الخلقي في جميع أنحاء العالم. ومع ذلك ، فإن أعراض الحالة أكثر شيوعًا. لا يجب أن يكون نقص enteropeptidase موجودًا دائمًا. نظرًا لأن التربسين يلعب دورًا رئيسيًا في تنشيط الإنزيمات الهضمية ، فإن الخلل أو النقص في التربسين يؤدي أيضًا إلى أعراض مماثلة. علاج هذه الأمراض هو نفسه في كلتا الحالتين. تدار الإنزيمات في شكل منشط. هناك بالتأكيد العديد من الحالات غير المشخصة لنقص إنتيروبيبتيداز.
إذا كان التشخيص مؤكدًا ، يمكن أيضًا استبدال إنتيروبيبتيداز. يحدث نقص إنتيروبيبتيداز أيضًا بشكل ثانوي بسبب أمراض معوية حادة.يجب توضيح الأمراض مثل الداء البطني ، الأمعاء الدقيقة القصيرة ، نقص اللاكتيز أو غيرها في التشخيص التفريقي.



.jpg)

.jpg)

.jpg)
.jpg)




.jpg)