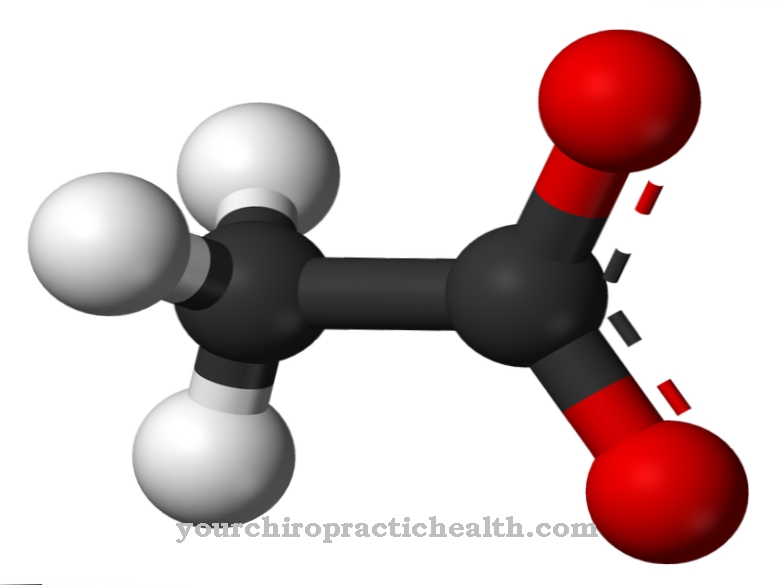
الهوموسيستين هو حمض ألفا أميني غير بروتيني المنشأ يحتوي على الكبريت ، والذي يتشكل كوسيط من الميثيونين عن طريق إطلاق مجموعة الميثيل (-CH3).
لمزيد من معالجة الهوموسيستين ، من الضروري توفير إمدادات كافية من الفيتامينات B12 و B6 وكذلك حمض الفوليك أو البيتين كمورد لمجموعات الميثيل. يرتبط زيادة تركيز الهوموسيستين في بلازما الدم بتلف جدران الأوعية الدموية والخرف والاكتئاب.
ما هو الهموسيستين؟
الحمض الأميني في شكله النشط بيولوجيًا هو حمض أميني غير بروتيني. لا يمكن أن يكون لبنة بناء للبروتين لأنه يميل إلى تكوين حلقة حلقية غير متجانسة لا تسمح برباط ببتيد مستقر بسبب مجموعة CH2 الإضافية مقارنة بسيستين.
لذلك فإن دمج الهوموسيستين في البروتين سيؤدي إلى انهيار البروتين قريبًا. توضح الصيغة الكيميائية C4H9NO2S أن الحمض الأميني يتكون حصريًا من مواد متوفرة بكثرة في كل مكان تقريبًا. العناصر النادرة والمعادن النادرة والمعادن ليست مطلوبة لبنيتها. Homocysteine هو zwitterion لأنه يحتوي على مجموعتين وظيفيتين ، كل منهما لها شحنة موجبة وسالبة ، والتي بشكل عام متوازنة كهربائيًا.
في درجة حرارة الغرفة ، يعتبر الهوموسيستين مادة صلبة بلورية مع نقطة انصهار من 230 إلى 232 درجة مئوية. يمكن للجسم أن يكسر مستوى الهوموسيستين المتزايد في الدم عن طريق جزيئين من الحمض الأميني يشكلان جسر ثاني كبريتيد لتكوين الهوموسيستين ، والذي يمكن بعد ذلك إفرازه عن طريق الكلى.
الوظيفة والتأثير والمهام
تتمثل أهم مهمة ووظيفة L-homocysteine في دعم تخليق البروتينات وتحويلها إلى S-adenosylmethionine (SAM) بالتعاون مع بعض الإنزيمات المساعدة. مع ثلاث مجموعات ميثيل (-CH3) ، يعد SAM أهم متبرع لمجموعة الميثيل في عملية التمثيل الغذائي الخلوي.
يشارك SAM في العديد من تفاعلات التخليق الحيوي وإزالة السموم. تأتي مجموعات الميثيل لبعض النواقل العصبية مثل الأدرينالين والكولين والكرياتين من SAM. بعد إطلاق مجموعة الميثيل ، تقوم SAM بإنتاج S-adenosylmethionine (SAH) ، والذي يتم تحويله مرة أخرى إلى الأدينوزين أو L-homocysteine مرة أخرى عن طريق التحلل المائي. على الرغم من أهمية الوظيفة الداعمة للهوموسيستين لبعض عمليات التمثيل الغذائي ، من المهم أيضًا ألا يحدث الهوموسيستين ، كمنتج وسيط لهذه التفاعلات الكيميائية الحيوية وسلاسل التخليق ، بتركيزات غير طبيعية في الدم لأنه يؤدي إلى ظهور آثار ضارة.
الهوموسيستين الزائد ، الذي ليس مطلوبًا لدعم التفاعلات الموصوفة أعلاه في استقلاب الميثيونين ، يتم تكسيره عادةً بمشاركة فيتامين ب 6 (البيريدوكسين) ويتم إفرازه عن طريق الكلى بعد تكوين الهوموسيستين. من أجل أداء الهموسيستين لمهامه الأيضية ، من المهم تزويد الجسم بكميات كافية من الفيتامينات B6 و B12 وحمض الفوليك.
التعليم والوقوع والخصائص والقيم المثلى
يتم إنتاج الهوموسيستين في الجسم كمنتج وسيط قصير العمر ضمن عملية التمثيل الغذائي للميثيونين المعقد. يشير التعيين البديل (S) -2-amino-4-mercaptobutanoic acid إلى بنية الهوموسيستين. لذلك فهو حمض أحادي الكربوكسيل مع مجموعة الكربوكسي المميزة (-COOH) وفي نفس الوقت حمض دهني بسيط. لا يمتص الهوموسيستين من خلال الطعام ، ولكنه ينتج مؤقتًا فقط في الجسم.
على الرغم من أن L-cysteine النشط بيولوجيًا يلعب دورًا مهمًا في تخليق البروتين وفي تكوين SAM ، فإن التركيز الأمثل وفي نفس الوقت المسموح به في الدم يقع ضمن حدود ضيقة فقط من 5 إلى 10 ميكرو مول / لتر. تشير مستويات الهوموسيستين المرتفعة إلى اضطرابات استقلابية معينة وتؤدي إلى الصورة السريرية لفرط الهوموسيستين في الدم. من المرجح أن يعتمد التركيز الأمثل للحمض الأميني على النشاط العقلي والبدني ذي الصلة ويصعب تحديده. يبدو تعريف الحد الأعلى المسموح به لمستوى الهوموسيستين ، والذي يجب أن يكون حوالي 10 ميكرو مول / لتر ، أكثر منطقية.
الأمراض والاضطرابات
إذا تجاوز تركيز الهوموسيستين الحد المسموح به ، فهناك في الغالب اضطرابات استقلابية مكتسبة أو محددة وراثيًا في توازن الميثيونين.
غالبًا ما يكون هناك نقص في الفيتامينات الضرورية B6 (البيريدوكسين) و B9 (حمض الفوليك) و B12 (الكوبالامين) ، والتي تكون مطلوبة كأنزيمات مساعدة أو محفزات داخل سلسلة التحويل البيوكيميائي. من المعروف أن ما مجموعه حوالي 230 طفرة جينية - وإن كانت نادرة الحدوث - تؤدي إلى اضطراب استقلاب الميثيونين. تسمى الزيادة المرضية في الهوموسيستين بيلة هوموسيستينية. توجد الطفرات الجينية الأكثر شيوعًا التي تسبب المرض في موضع الجين 21q22.3. الطفرة هي وراثي جسمي متنحي وتتسبب في تكوين إنزيم معيب مطلوب لعملية تكسير وتحويل الهوموسيستين.
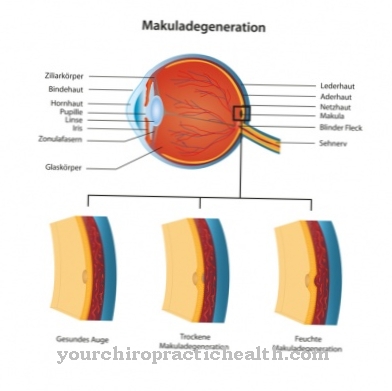
الطفرات المعروفة سابقًا هي حذف (حذف) أو إضافة (إدخال) القواعد النووية على خيوط الحمض النووي المقابلة. يمكن أن تؤدي الظروف والعادات المعيشية غير المواتية أيضًا إلى زيادة مستويات الهوموسيستين. وتشمل هذه الاستهلاك المفرط للكحول وتعاطي النيكوتين وزيادة الوزن ونمط الحياة المستقرة. يمكن أن يؤدي مستوى الهوموسيستين المفرط إلى تلف البطانة والجدار الداخلي للأوعية الدموية و ب. تعزيز تصلب الشرايين. تصبح الأوردة غير مرنة وتسبب عددًا من الأمراض الثانوية مثل ارتفاع ضغط الدم. كما أنها تحمل خطر تكوين الجلطات التي تسبب أمراض القلب التاجية والسكتات الدماغية.
ترتبط الأمراض العصبية مثل الاكتئاب والخرف أيضًا بارتفاع مستوى الهوموسيستين. تختلف أعراض المرض بشكل كبير عند الأطفال الذين يعانون من بيلة هوموسيستينية وراثية. يتراوح طيف الأعراض من خصائص مرض بالكاد يمكن اكتشافها إلى ظهور جميع الأعراض الممكنة تقريبًا. تظهر الأعراض الأولى عادةً بعد بلوغ سن الثانية. على الأكثر ، يمكن ملاحظة حدوث تباطؤ في التطور النفسي خلال العامين الأولين من الحياة. في كثير من الحالات ، يكون أول أعراض بيلة هوموسيستينية الجينية هو تدلي عدسة العين.


.jpg)



.jpg)




.jpg)