التشخيص مرض هيرلر يرتبط بعبء نفسي وجسدي هائل ليس فقط للمصابين ، ولكن أيضًا للوالدين ، حيث أن المرض ليس له أعراض معقدة للغاية فحسب ، بل له أعراض خطيرة أيضًا. وفقًا للحالة الطبية الحالية ، فإن مرض هيرلر غير قابل للشفاء. يجب علاج المصابين بنخاع العظام أو زرع الخلايا الجذعية المكونة للدم (BMT) والعلاج ببدائل الإنزيم في وقت مبكر مثل الرضاعة أو الطفولة المبكرة. هذه هي الطريقة الوحيدة لتمضية سنوات البلوغ.
ما هو مرض هيرلر؟

© آدم جان فيجي - stock.adobe.com
التشخيص مرض هيرلر يحدد أشد أشكال مرض التخزين الليزوزومي داء عديد السكاريد المخاطي من النوع الأول (MPS I). وصف طبيب الأطفال جيرترود هيرلر ، لأول مرة ، مسار مرض التخزين الليزوزومي النادر مع تشوهات هيكلية وتأخر في التطور الحركي والفكري. الاسم مشتق من اسمك.
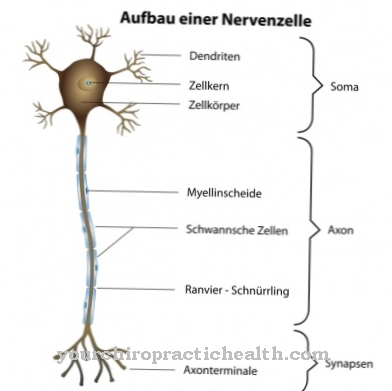
حاليًا ، هناك تمييز متزايد بين MPS I بما في ذلك تورط الجهاز العصبي المركزي (ZMS) و MPS I دون تدخل. ومع ذلك ، فإن الجهاز العصبي المركزي يشارك دائمًا في مرض هيرلر. لحسن الحظ ، هذا المرض نادر جدا. التقدير حوالي 1: 145000 ولادة. ومع ذلك ، فإن مرض هيرلر هو الأكثر شيوعًا عند 1: 100000.
الأسباب
مرض هيرلر أيضًا متلازمة هيرلر بفاوندر يسمى ، في جين IDUA عن طريق الطفرات التي تسبب خللًا أو فقدانًا تامًا لنشاط إنزيم alpha-L-iduronidase. والنتيجة هي تراكم الجليكوزامينوجليكان (GAG) واختلال استقلاب الخلية.
بسبب عيب الإنزيم ، لم يعد من الممكن تكسير المينوجليكان وتفكيكه بشكل كافٍ. بدلا من ذلك ، يتم تخزينها في الجسيمات الحالة لخلايا الجسم. قبل كل شيء ، تتراكم كبريتات ديرماتان وكبريتات الهيبارين. هذا يضعف بشدة وظيفة الخلية ، ويخلق الأعراض التي تؤدي إلى مرض هيرلر.
الأعراض والاعتلالات والعلامات
الأعراض ، الأعراض ، واسعة جدًا وعادة ما تكون بالفعل في مرحلة الطفولة. تتميز الصورة السريرية بقصر القامة والتهاب الأذن المتكرر بالإضافة إلى مشاكل الجهاز التنفسي الانسدادي والتقييدية ، والتي ترتبط غالبًا بالتهابات رئوية.
الفتق السري والأربي ، وبعضها متكرر ، وخلل التنسج الفخذي أحادي الجانب أو الثنائي بالإضافة إلى الحدبة (حدبة مدببة في العمود الفقري) وتقلصات المفاصل المختلفة أو تصلب المفاصل هي أيضًا جزء من الصورة السريرية. إن ضغط الحبل الشوكي في منطقة الجزء العلوي من العمود الفقري العنقي (العمود الفقري العنقي) عند الوصل القحفي الرقبي هو أيضًا عرض متكرر.
غالبًا ما تحدث متلازمة النفق الرسغي في مرحلة الطفولة. في السنة الثالثة من العمر ، غالبًا ما تعاني العيون من عتامة القرنية ، ويطور السمع بشكل متزايد ضعف السمع ويتضخم اللسان (ضخامة اللسان). بالإضافة إلى ذلك ، يمكن أن يحدث انقطاع النفس النومي والتخلف العقلي. الرأس كبير نسبيًا ولا تتسع الشفتان بشكل متكرر.
يمكن أن يحدث تضخم عضوي (تضخم غير طبيعي للأعضاء) وكذلك الفتق والشعرانية (زيادة نمو الشعر المعتمد على الأندروجين). وكثيرا ما يلاحظ أيضا اعتلال عضلة القلب مع اضطراب الصمام. يمكن ملاحظة المظهر النموذجي في المرضى المصابين. وتشمل رقبة قصيرة ولسان متضخم وجسر أنف عميق.
عادة ما يكون النمو طبيعيًا حتى سن الثالثة. ومع ذلك ، يمكن أن تحدث تأخيرات في النمو بين الشهر الثاني عشر والرابع والعشرين من العمر. يمكن أن يحدث استسقاء الرأس أيضًا في السنة الثانية من العمر. غالبًا ما ينتهي النمو بارتفاع 1.20 متر. نمط المشي هو أيضًا مميز جدًا بسبب سوء التموضع.
ليس فقط تضخم اللسان الذي سبق ذكره ، ولكن أيضًا تضيق المسالك الهوائية وانخفاض مرونة أنسجة الرئة هي المسؤولة عن تقييد التنفس. يمكن أن تؤثر عتامة القرنية بشكل تدريجي على الرؤية بمرور الوقت.
التشخيص ومسار المرض
يمكن تشخيص مرض هيرلر من خلال [[عينة دم]] من الدم لتحديد نشاط إنزيم alpha-L-iduronidase. التشخيص قبل الولادة باستخدام الإنزيمات وعلم الوراثة الجزيئي ممكن أيضًا.
يمكن تقسيم الصورة السريرية إلى ثلاثة أشكال لأن عيب الإنزيم يعتمد على طفرات مختلفة. أشكال التدرج الثلاثة هي:
- مرض هيرلر الشديد
- مرض هيرلر / شي (M. Hurler / Scheie) بشكل متوسط
- مرض Scheie (M. Sheie) في شكل خفيف
المضاعفات
كقاعدة عامة ، يسبب مرض هيرلر عددًا من الشكاوى والمضاعفات المختلفة. تحد أعراض هذا المرض من الحياة اليومية للمتضررين بشدة ، بحيث يتعين عليهم في معظم الحالات الاعتماد على مساعدة الآخرين أو على مساعدة الوالدين ومقدمي الرعاية. يتم أيضًا تقليل جودة حياة الشخص المعني والوالدين وتقييدها بشكل كبير.
كقاعدة عامة ، يعاني المرضى من قصر القامة الواضح وصعوبات في التنفس. كما يمكن أن يؤدي ذلك إلى ضيق التنفس وفي أسوأ الحالات إلى وفاة المريض. المفاصل أيضًا صلبة ولا يمكن تحريكها بسهولة. هذا يؤدي إلى تقييد الحركة وتأخير كبير في نمو الطفل.
في معظم الحالات ، يكون نظر المريض وسمعه مصدر إزعاج أيضًا ، لذلك في أسوأ الحالات ، يمكن أن يتسبب مرض هيرلر في إصابته بالعمى التام أو فقدان سمعه. علاوة على ذلك ، يؤدي هذا المرض أيضًا إلى التخلف ، بحيث يعتمد المرضى على دعم خاص. لسوء الحظ ، فإن المرض نفسه غير قابل للشفاء ، لذلك لا يمكن تقييد سوى عدد قليل من الأعراض. في كثير من الحالات ، يحتاج الآباء والأقارب أيضًا إلى علاج نفسي.
متى يجب أن تذهب إلى الطبيب؟
مع مرض هيرلر ، تظهر على الأطفال بالفعل أعراض واضحة للمرض. فور اكتشاف المخالفات الأولى ، تحتاج إلى مساعدة طبية ، حيث أن الأعراض ضارة جدًا بنوعية حياة المريض. يُنصح بزيارة الطبيب في حالة وجود صعوبات في التنفس أو التهابات متكررة أو قصر القامة. في حالة الاشتباه في وظيفة الجهاز التنفسي أثناء النوم الليلي ، يجب مناقشة ذلك مع الطبيب. إذا كانت هناك مضاعفات في التنقل ، فهناك أيضًا ما يدعو للقلق. يجب أن يُعرض على الطبيب تيبس المفاصل واضطرابات في تسلسل الحركة ومشاكل في الحركة.
تعتبر التشوهات البصرية أو التشوهات في نظام الهيكل العظمي علامات على وجود اضطراب صحي. إذا كانت وظيفة اليد محدودة أو إذا أصبحت القرنية غائمة ، يلزم الطبيب. يجب على الطبيب توضيح انخفاض تنمية المهارات الفكرية ، أو إعاقة التعلم أو اضطرابات النمو في اللغة.
تعتبر اضطرابات النمو العامة ، أو رأس الماء ، أو تضخم اللسان ، أو جذر الأنف العميق من سمات مرض هيرلر ، ويجب عرضها على الطبيب في أسرع وقت ممكن. عادة ، يمكن التعرف على الاضطرابات بوضوح من سن الثانية. يعتبر ضعف السمع أو البصر من الدلائل الأخرى على وجود اضطراب قائم ويجب فحصه طبياً.
العلاج والعلاج
يجب أن يتم العلاج بالتأكيد من قبل فريق متعدد التخصصات من الأطباء والمعالجين. في حالة إصابة الجهاز العصبي المركزي ، يلزم العلاج في أقرب وقت ممكن على شكل نخاع العظام أو زرع الخلايا الجذعية المكونة للدم (BMT). يجب أن يتم ذلك للأطفال الصغار حتى سن 2.5 سنة.
تحتوي الزرع على خلايا الدم التي تنتج إنزيم alpha-L-iduronidase. للقيام بذلك ، تطلق هذه الخلايا جزءًا من الإنزيم المتشكل والسليم في البيئة. ثم يتم تناول هذا بواسطة خلايا الجسم الأخرى وينتقل إلى الجسيمات الحالة. يمكن الآن تفكيك الجليكوزامينوجليكان المخزن مرة أخرى.
فقط من خلال عملية الزرع يمكن أن يتأثر التطور المعرفي وبالتالي متوسط العمر المتوقع بشكل إيجابي. بالإضافة إلى ذلك ، يتم إجراء العلاج ببدائل الإنزيم بعد ذلك. يُستبدل الإنزيم المعيب بشكل إنزيم بشري مُصنَّع بالتكنولوجيا الحيوية. الآن يمكن تفكيك التخزين المرضي للجليكوزامينوجليكان مرة أخرى.
ولكن بسبب الحاجز الدموي الدماغي ، فإن استبدال الإنزيم لا يصل إلى الجهاز العصبي المركزي. نتيجة لذلك ، لا يمكن أن يكون لهذا الشكل من العلاج أي تأثير على الأعراض الإدراكية والحركية. كما هو الحال حاليًا ، يمكن فقط لزرع الخلايا الجذعية القيام بذلك. في الفترة التي تسبق عملية الزرع ، يمكن استقرار الحالة العامة للمريض أو تحسينها من خلال العلاج ببدائل الإنزيم.
ويمكنه أيضًا دعم عملية الزرع وتخفيف الأعراض. لا يمكن لزرع BMT أن يعالج مرض هيرلر من وجهة نظر تنبؤية بحتة ، يمكن للمرضى الذين يعانون من مثل هذا العلاج الوصول إلى مرحلة البلوغ المبكرة قبل أن يموتوا بسبب مضاعفات القلب والأوعية الدموية والجهاز التنفسي.
التوقعات والتوقعات
يعتبر المرض عبئًا نفسيًا وجسديًا هائلاً ليس فقط على الشخص المصاب ، ولكن أيضًا على الوالدين ، لأن مرض هيرلر ليس له أعراض معقدة فحسب ، بل خطيرة جدًا أيضًا. وفقًا للمعرفة الحالية ، فإن المرض غير قابل للشفاء. يجب أن يعالج المرضى من سن مبكرة بنخاع عظمي أو زرع خلايا جذعية ، بالإضافة إلى العلاج ببدائل الإنزيم. هذه هي الطريقة الوحيدة لإطالة العمر بعد سن البلوغ.
يسبب المرض في معظم الحالات مجموعة متنوعة من الشكاوى والمضاعفات. إن آثار المرض تحد بشدة من حياة المرضى ، لذلك غالبًا ما يعتمدون على مساعدة مقدمي الرعاية أو العائلات. بالإضافة إلى ذلك ، فإن نوعية حياة المتضررين وأسرهم يتم تقليلها وتقليصها بشكل كبير. غالبًا ما يعاني المريض من قصر القامة الواضح جدًا ويعاني من صعوبات شديدة في التنفس.
وغالبًا ما يؤدي ذلك إلى ضيق في التنفس وفي الحالات القصوى يؤدي إلى وفاة الشخص المعني. بالإضافة إلى ذلك ، غالبًا ما تكون المفاصل متيبسة ويصعب تحريكها دون ألم. هذا يؤدي إلى تقييد الحركة وتأخر شديد في النمو لدى الأطفال المصابين. غالبًا ما يكون هناك أيضًا مشاكل في السمع والبصر لدى المرضى ، حتى أنهم قد يصابون بالعمى تمامًا بسبب المرض ويفقدون سمعهم.
منع
مرض هيرلر هو عيب وراثي خلقي. لذلك ، لا يمكن استخدام العلاج الوقائي. ومع ذلك ، فمن أجل الهندسة الوراثية ، ينبغي النظر إلى المستقبل بشكل إيجابي.
الرعاية اللاحقة
يعتمد مرض هيرلر على خلل جيني ويكون شديدًا في معظم الحالات. يمكن للمصابين فقط المساهمة في العلاج إلى حد محدود للغاية. في بداية المرض ، تقتصر إجراءات المساعدة الذاتية عادةً على الاستفادة من عروض العلاج النفسي التي يمكن أن تسهل على المريض قبول المرض.
غالبًا ما تساعد مجموعات المساعدة الذاتية ، التي يتم فيها تبادل مع مرضى آخرين ، في اكتشاف وجهات نظر جديدة في الحياة والتعامل مع الحياة اليومية مع هذا المرض الخطير. مرفق صديق للمعاقين في بيئة المعيشة يسمح للمتضررين بمزيد من حرية الحركة. غالبًا ما تدعم العلاجات التخاطبية والسلوكية المواجهة النفسية للمريض مع المرض.
في المراحل المتقدمة من المرض ، غالبًا ما تكون المساعدة من طاقم تمريض مدرب مطلوبًا. بالطبع ، يمكن أن يكون لدعم الأقارب والأصدقاء تأثير إيجابي على نمط حياة الشخص. كما تساعد التمارين المعتدلة وتجنب الإجهاد النفسي واتباع نظام غذائي خاص في تحسين الحالة.
يمكن لمفكرة الشكاوى أن تساعد في تحديد الأعراض والشكاوى غير العادية في وقت مبكر من أجل منع المضاعفات التي تهدد الحياة. التواصل المستمر مع الطبيب المعالج ضروري. في المرحلة الأخيرة من المرض ، تقتصر إجراءات التخفيف على إعطاء الأدوية المسكنة للألم ، والتي يجب تناولها وفقًا لوصفة الطبيب.
يمكنك أن تفعل ذلك بنفسك
عادةً ما يأخذ مرض هيرلر مسارًا شديدًا ولا يمكن علاجه إلا بدرجة محدودة من قبل المصابين. وبناءً على ذلك ، فإن أهم تدبير للمساعدة الذاتية يركز على الاستفادة من تدابير العلاج النفسي. التحدث إلى المعالج ، من ناحية ، وزيارة مجموعة المساعدة الذاتية ، من ناحية أخرى ، يوفر للمرضى فرصًا لقبول المرض. بالإضافة إلى ذلك ، يمكن تطوير منظور جديد للحياة من خلال المحادثة مع الأشخاص المتضررين الآخرين.
بالإضافة إلى ذلك ، يجب اتخاذ خطوات لجعل الحياة اليومية أسهل مع المرض. يمكن أن يكون هذا هو تركيب مرفق مناسب لذوي الاحتياجات الخاصة ، ولكن أيضًا العلاج السلوكي والمحادثة. يحتاج الأشخاص الذين تقدم لديهم مرض هيرلر بالفعل إلى رعاية أخصائي. يمكن للأصدقاء والأقارب أن يكونوا دعمًا مهمًا خلال هذا الوقت.
سيوصي الطبيب أيضًا بإجراءات مثل تغيير النظام الغذائي وممارسة الرياضة وتجنب الإجهاد. يمكن أن يؤدي هذا ومذكرة الشكاوى إلى حياة خالية نسبيًا من الأعراض على الرغم من المرض. والشرط الأساسي لذلك هو إبلاغ الطبيب بجميع الأعراض والشكاوى غير العادية. قد يؤدي عدم القيام بذلك إلى مضاعفات تهدد الحياة وتتطلب المزيد من العلاج. في المراحل الأخيرة من المرض ، تركز إجراءات المساعدة الذاتية على تناول مسكنات الألم حسب توجيهات الطبيب المعالج.

.jpg)
.jpg)

.jpg)