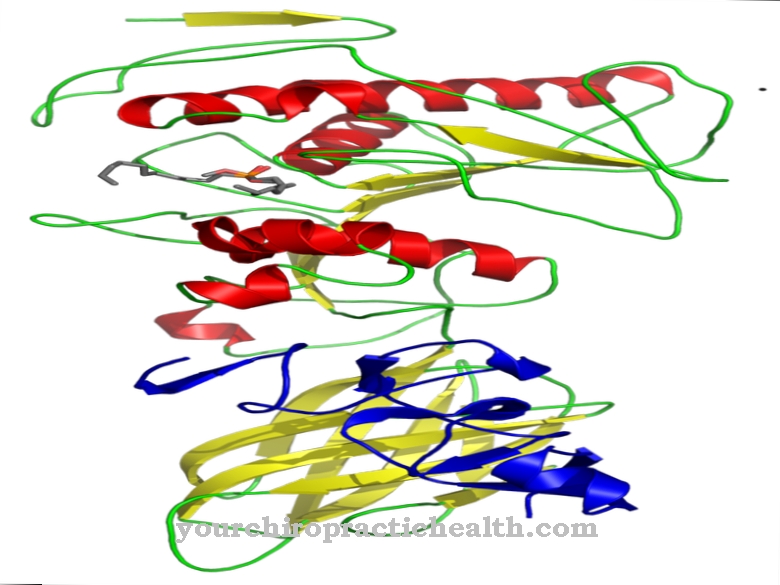
ال مضخة الصوديوم والبوتاسيوم هو بروتين عبر الغشاء مثبت بقوة في غشاء الخلية. بمساعدة هذا البروتين ، يمكن أن تنتقل أيونات الصوديوم خارج الخلية وأيونات البوتاسيوم إلى الخلية.
ما هي مضخة الصوديوم والبوتاسيوم؟
مضخة الصوديوم والبوتاسيوم هي مضخة تقع في غشاء الخلية. من خلال نقل أيونات الصوديوم والبوتاسيوم ، فإنه يضمن الحفاظ على إمكانات غشاء الراحة المزعومة.
في كل دورة ضخ ، يتم تبادل ثلاثة أيونات الصوديوم (أيونات الصوديوم) لاثنين من أيونات البوتاسيوم (أيونات البوتاسيوم). هذا يخلق إمكانات سلبية في الفضاء داخل الخلايا. عند نقل هذه الأيونات ، تستهلك مضخة الصوديوم والبوتاسيوم الطاقة على شكل أدينوسين ثلاثي الفوسفات (ATP).
الوظيفة والتأثير والمهام
تعمل مضخة الصوديوم والبوتاسيوم بشكل أساسي كبروتين ناقل. يحتوي على ثلاثة مواقع ربط لأيونات الصوديوم وموقعين لربط أيونات البوتاسيوم. يوجد أيضًا موقع ملزم لـ ATP. باستخدام ATP ، يمكن لمضخة الأيونات نقل ثلاثة أيونات الصوديوم من بلازما الخلية إلى الفضاء خارج الخلية. في المقابل ، يقوم بتهريب اثنين من أيونات البوتاسيوم من السيتوبلازم إلى الخلية. تتم هذه العملية في عدة خطوات.
في البداية ، يكون البروتين الناقل مفتوحًا للسيتوبلازم. تدخل ثلاثة أيونات الصوديوم إلى البروتين من خلال الفتحة وترتبط بمواقع الارتباط المحددة. في داخل غشاء البروتين ، يستقر جزيء ATP أيضًا في موقع الارتباط المحدد. ثم ينقسم هذا الجزيء مع إطلاق الماء. ترتبط مجموعة الفوسفات الناتجة لفترة قصيرة بحمض أميني لمضخة الصوديوم والبوتاسيوم. يتم إطلاق الطاقة عندما ينهار جزيء ATP. هذا يغير الترتيب المكاني لمضخة الصوديوم والبوتاسيوم ويفتح البروتين الحامل في اتجاه الفضاء خارج الخلية.
ثم تنفصل أيونات الصوديوم الثلاثة عن نقاط الربط الخاصة بها وبالتالي تدخل إلى الوسط الخارجي. يدخل اثنان من أيونات البوتاسيوم الآن إلى البروتين من خلال الفجوة المفتوحة. هذه أيضًا مرتبطة بمواقع الربط. تم تقسيم مجموعة الفوسفات المربوطة الآن.هذا يغير شكل مضخة الصوديوم والبوتاسيوم إلى حالتها الأصلية. تذوب أيونات البوتاسيوم الآن وتتدفق إلى داخل الخلية. من خلال هذه العملية ، تحافظ مضخة الصوديوم والبوتاسيوم على ما يُعرف باسم إمكانات غشاء الراحة.
التعليم والوقوع والخصائص
يصف إمكانات غشاء الراحة إمكانات الغشاء للخلايا التي يحتمل أن تكون قابلة للاستثارة في حالة الراحة. تم العثور على إمكانات الغشاء بشكل خاص في الخلايا العصبية أو خلايا العضلات. اعتمادًا على نوع الخلية ، تتراوح إمكانات غشاء الراحة بين -100 و -50 مللي فولت. بالنسبة لمعظم الخلايا العصبية هو -70 مللي فولت. يتم شحن الجزء الداخلي للخلية سالبًا مقارنةً بالخارج.
تعد إمكانية الراحة للخلية شرطًا أساسيًا لتوصيل الإثارة في الأعصاب وللتحكم في تقلص العضلات. يمكن إعاقة مضخة الصوديوم والبوتاسيوم بمواد مختلفة. على سبيل المثال ، تثبط جليكوسيدات القلب البروتين الحامل. توصف جليكوسيدات القلب لفشل القلب المزمن والرجفان الأذيني. عن طريق تثبيط المضخة ، يبقى المزيد من الصوديوم في الخلايا. يتقارب تركيز الصوديوم داخل الخلايا مع تركيز الصوديوم خارج الخلية.
عن طريق تثبيط مبادل الصوديوم والكالسيوم ، يبقى المزيد من الكالسيوم في الخلية. هذا يزيد من انقباض القلب. يمكن أن يؤدي تثبيط مضخة الصوديوم والبوتاسيوم أيضًا إلى فرط بوتاسيوم الدم. على العكس من ذلك ، يمكن أيضًا تحفيز مضخة الصوديوم والبوتاسيوم دوائيًا. يتم ذلك ، على سبيل المثال ، عن طريق إعطاء الأنسولين أو الأدرينالين. قد يؤدي تحفيز المضخة إلى نقص بوتاسيوم الدم.
الأمراض والاضطرابات
من الأمراض النادرة جدًا التي تعتمد على وجود خلل في مضخة الصوديوم والبوتاسيوم هي البداية الحادة لمتلازمة باركنسون وخلل التوتر العضلي. إنه مرض موروث كصفة جسمية سائدة. يبدأ عادة في مرحلة الطفولة أو المراهقة.
يحدث خلل التوتر العضلي المصحوب بالرعشة والتشنجات والحركات اللاإرادية في غضون ساعات. بعد وقت قصير ، هناك نقص حاد في ممارسة الرياضة بما في ذلك الجمود. العلاج الفعال لهذا المرض غير معروف بعد.
تشير بعض الدراسات التي أجريت على الحيوانات إلى أن العيوب في مضخة الصوديوم والبوتاسيوم قد تكون سببًا محتملاً للصرع. أثناء البحث عن العيوب الجينية التي يمكن أن تسبب الصرع ، صادف الباحثون طفرة في جين ATP1a3. هذا هو المسؤول عن عمل مضخة الصوديوم والبوتاسيوم. يُعرف الصرع في اللغة الألمانية أيضًا باسم التشنجات أو الصرع. تختلف الأعراض باختلاف منطقة الدماغ التي خرجت منها أثناء النوبة.
على سبيل المثال ، يمكن أن يحدث ارتعاش أو توتر في العضلات ، ويمكن للمصابين أن يعبروا عن أنفسهم بصوت عالٍ في الهجمات أو يرون البرق أو الخطوط أو الظلال. يمكن أن تحدث أيضًا اضطرابات الرائحة الكريهة أو اضطرابات الإدراك الصوتي. يمكن أن تكون حالة الصرع المزعومة على وجه الخصوص مهددة للحياة. هذه نوبات توترية رمعية عامة يمكن أن تستمر من 5 إلى 30 دقيقة.
يمكن أن يكون الخلل في مضخة الصوديوم والبوتاسيوم سببًا محتملاً للصداع النصفي. اكتشف الباحثون تغيرات جينية على الكروموسوم 1 في الصداع النصفي. يؤدي هذا الجين إلى خلل في مضخة الصوديوم والبوتاسيوم في أغشية الخلايا. والنتيجة هي خلايا منتفخة ومستديرة. من المفترض أن يسبب هذا الألم المميز للصداع النصفي. الصداع النصفي هو مرض عصبي يصيب حوالي 10٪ من السكان. تتأثر النساء بشكل ملحوظ أكثر من الرجال. الصورة السريرية للصداع النصفي متغيرة للغاية.
عادة ، يتعلق الأمر بالنوبات والصداع النابض وأحادي الجانب. تتكرر هذه بشكل دوري. يمكن أن تحدث أيضًا أعراض مثل الغثيان والقيء والحساسية للضوضاء أو الحساسية للضوء. أبلغ بعض المرضى عن اضطرابات بصرية أو حسية في الإدراك قبل نوبة الصداع النصفي الفعلية. يتحدث المرء هنا عن هالة الصداع النصفي. الصداع النصفي هو تشخيص للإقصاء ولا يمكن علاجه حاليًا.


.jpg)
.jpg)


.jpg)




.jpg)