في ال مسار الإنقاذ يتم تصنيع جزيء حيوي جديد من منتجات التحلل لجزيء حيوي. يُعرف مسار الإنقاذ أيضًا باسم مسار الاسترداد وهو ، إذا جاز التعبير ، شكل من أشكال إعادة التدوير داخل عملية التمثيل الغذائي.
ما هو مسار الإنقاذ؟
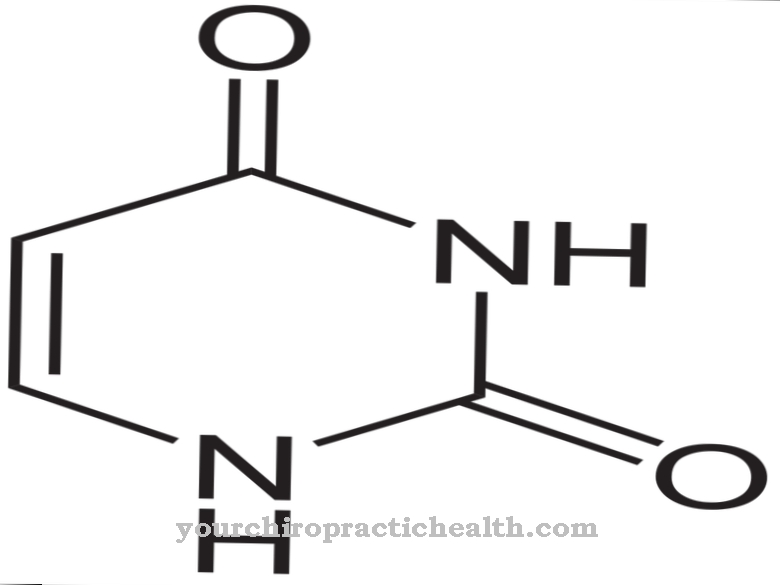
يشير مسار الإنقاذ إلى الشكل العام لإعادة التدوير داخل عملية التمثيل الغذائي من ناحية والمسار الأيضي لنيوكليوتيدات البيورين من ناحية أخرى. نيوكليوتيدات البيورين هي لبنات البناء الكيميائية الأساسية للحمض النووي الريبي منقوص الأكسجين (DNA) والحمض النووي الريبي (RNA).
في عملية إنقاذ النوكليوتيدات البوتينية ، تتشكل أحاديات النيوكليوتيدات من قواعد البيورين ، الجوانين والأدينين والهيبوكسانثين. بنسبة 90 ٪ ، يعد هذا المسار الأيضي هو المسار الأيضي الرئيسي للبيورينات المجانية. يتم تقسيم الباقي إلى حمض البوليك. يوفر مسار الإنقاذ العديد من المزايا ، خاصةً بالمقارنة مع التخليق الحيوي للبيورين أحادي نيوكليوتيدات البيورين. على سبيل المثال ، هو أكثر كفاءة في استخدام الطاقة بشكل ملحوظ.
التشريح والهيكل
يتطلب تخليق قواعد البيورين ثنائية الحلقات بذل الكثير من الجهد للجسم. لذلك ، يتم تقسيمها إلى قواعد بسيطة ثم استخدامها مرة أخرى.
في مسار إعادة التدوير ، يتم استخدام العديد من المنتجات الوسيطة لتكسير أحاديات النيوكليوتيدات أو النيوكليوسيدات أو عديد النيوكليوتيدات أو قواعد الأحماض النووية في بناء التفاعلات بدلاً من تفكيكها تمامًا. من خلال تفاعل مسار الإنقاذ ، يمكن حفظ المنتجات الوسيطة المفيدة والقيمة من عملية التمثيل الغذائي ، والتي تسمى المستقلبات ، من التخلص منها. لذلك لا يجب إنتاج هذه المستقلبات مرة أخرى. توفر هذه العملية الخلية استهلاكًا عاليًا للطاقة. في مسار الإنقاذ ، يتم نقل فوسفات الريبوز من بيروفوسفات الفوسفوريبوزيل (PRPP) إلى قاعدة البيورين الحرة.
يتكون النيوكليوتيد عن طريق فصل البيروفوسفات. يتم تنشيط الإنزيمات اللازمة لذلك بواسطة بيروفوسفات الفوسفوريبوزيل وتثبيطها بواسطة المنتجات النهائية. من قاعدة الأدينين البيورين ، يتشكل الأدينوزين أحادي الفوسفات (AMP) مع (PRPP) وعن طريق إنزيم الأدينين فسفوريبوزيل ترانسفيراز (APRT). فيما يتعلق بـ PRPP وإنزيم Hypoxanthine-guanine-phosphoribosyltransferase (HGPRT) ، يصبح الجوانين هو نيوكليوتيد guanosine أحادي الفوسفات (GMP). مع PRPP وإنزيم hypoxanthine-guanine-phosphoribosyltransferase ، يصبح Hypoxanthine هو نيوكليوتيد إينوزين أحادي الفوسفات (IMP).
الإنزيمات الأخرى التي تشارك في مسار الإنقاذ هي فسفوريلاز نيوكليوزيد ، كينازات نيوكليوزيد وكينازات نيوكليوتيد. يتم تحويل 90٪ من البيورينات أولاً إلى نيوكليوتيدات ثم يتم استخدامها مرة أخرى لتخليق الأحماض النووية من خلال التحويلات. 10٪ من البيورينات تتحلل إلى حمض البوليك وتفرز عن طريق الكلى.
الوظيفة والمهام
يحدث مسار الإنقاذ في جميع خلايا الجسم تقريبًا ، حيث يتم تكسير البيورينات في جميع خلايا الجسم تقريبًا. تنتمي البيورينات إلى مجموعة الدورات غير المتجانسة ، وإلى جانب البيريميدينات ، تعد اللبنات الأساسية الأكثر أهمية للأحماض النووية. تتشكل البيورينات باستخدام مسار الإنقاذ نفسه. وهي موجودة في جميع الخلايا التي لها نواة.
تحتوي الأطعمة من أصل حيواني ، وخاصة المخلفات والجلد ، على الكثير من البيورينات. يتم تكسير البيورينات التي لا يتم إعادة تدويرها عبر مسار الإنقاذ إلى حمض البوليك وإفرازها عبر الكلى. لا توجد قيم دم لمسار الإنقاذ ، ولكن توجد قيم لحمض البوليك. عند الرجال ، تتراوح مستويات حمض اليوريك في الدم عادةً بين 3.4 و 7.0 مجم / 100 مل. يجب أن تتراوح قيمة حمض اليوريك عند النساء بين 2.4 و 5.7 مجم / لتر.
الأمراض
إذا كان هناك خلل في مسار الإنقاذ ، فلا يمكن إعادة تدوير البيورينات. يتم تكسير المزيد من البيورينات بشكل ملحوظ ، بحيث يتم إنتاج المزيد من حمض البوليك. لم تعد الكلى قادرة على إفراز حمض البوليك تمامًا ، مما يؤدي إلى فرط حمض اليوريك في الدم.
فرط حمض يوريك الدم هو زيادة في مستوى حمض البوليك في الدم. بحكم التعريف ، يوجد فرط حمض يوريك الدم من مستوى حمض البوليك البالغ 6.5 مجم / ديسيلتر. تنطبق القيمة الحدية بالتساوي على كلا الجنسين. تُعرف الزيادة في مستويات حمض اليوريك بسبب اضطراب مسار الإنقاذ أيضًا باسم فرط حمض يوريك الدم الأولي. حوالي 1٪ من حالات فرط حمض اليوريك في الدم ناتجة عن فرط إنتاج حمض البوليك بسبب اضطراب في استقلاب البيورين. تعتمد غالبية فرط حمض يوريك الدم الأولي على انخفاض إفراز حمض البوليك في الكلى.
من أجل التمييز ما إذا كانت قيم البول المتزايدة تستند إلى انخفاض الإخراج أو زيادة إنتاج حمض البوليك ، يجب تحديد تصفية حمض البوليك. لحساب تصفية حمض البوليك ، يتم تحديد إفراز حمض البوليك في جمع البول لمدة 24 ساعة وحمض البوليك في الدم.
في معظم الحالات ، يظل فرط حمض يوريك الدم بدون أعراض. في حالة فرط حمض يوريك الدم الهائل ، تحدث نوبة حادة من النقرس. هذا هو المكان الذي تترسب فيه الأملاح المتبلورة لحمض البوليك في المفاصل. هذا يؤدي إلى التهاب في المفاصل المصابة مع ارتفاع درجة الحرارة والألم والاحمرار الشديد. غالبًا ما يتأثر المفصل المشطي السلامي ومفصل الكاحل ومفصل الركبة بشكل خاص. إذا استمر النقرس لفترة طويلة ، يتم إعادة تشكيل الأنسجة. يتكاثف الغضروف الموجود في المفاصل ويتطور ما يسمى الحُصُوة النقرسية.
الخلل الجيني الذي يؤدي إلى فرط حمض يوريك الدم هو متلازمة ليش نيهان. يتم توريث المرض بطريقة متنحية مرتبطة بالكروموسوم X وينتج عنه نقص في إنزيم ناقلة الهيبوكسانثين - الجوانين - الفوسفوريبوزيل ترانسفيراز (HGPRT). نظرًا لأن الإنزيم متورط في استقلاب البيورين لقواعد البيورين هيبوكسانثين والجوانين ، يتم إنشاء المزيد من البيورينات للتحلل. والنتيجة ارتفاع حاد في حمض البوليك. يتم توريث المرض بطريقة مرتبطة بـ X. هذا هو السبب في أن الرجال يتأثرون بشكل حصري تقريبًا بمتلازمة ليش نيهان. تظهر الأعراض الأولى بعد حوالي عشرة أشهر من الولادة.
يظهر الأطفال موقفًا واضحًا في تركيبة مع نمط حياة مستقر وعجز في النمو. غالبًا ما تكون العلامة الأولى هي زيادة بقايا البول في الحفاض. في الحالات الشديدة ، يمكن أيضًا أن تحدث إصابات ذاتية مثل عضات الشفاه والأصابع وضعف التفكير. قد يتصرف الأطفال المصابون أيضًا بعدوانية تجاه والديهم أو أشقائهم أو أصدقائهم أو مقدمي الرعاية.





.jpg)

.jpg)

