تحت إفراز paracrine يتفهم الطب إفراز الهرمون في النسيج الخلالي ، والذي يؤثر على الخلايا في الجوار المباشر. يستخدم إفراز paracrine في المقام الأول لتمييز الأنسجة. على سبيل المثال ، يمكن أن تؤثر أمراض الباراكرين على تكوين العظام وتؤثر على نظام الغدد الصماء بأكمله.
ما هو إفراز باراكرين؟

إفراز باراكرين هو مسار إفراز من الغدد والخلايا الشبيهة بالغدة. لا يتم نقل إفرازات مثل عوامل النمو أو الهرمونات عن طريق الغدد الصماء عبر الدم إلى الأنسجة المستهدفة ، ولكنها تعمل على بيئتها المباشرة.
يعتبر إفراز المستبد شكلاً خاصًا من أشكال هذا المبدأ. في مسار الإفراز هذا ، تعمل المواد المُفرزة مرة أخرى على خلايا الإفراز نفسها. لهذا الغرض ، فإن الخلايا المفرزة نفسها مجهزة بمستقبلات يمكن لإفرازاتها أن ترتبط بها. على الرغم من أن الإفرازات مصممة للعمل خارج خلايا الغدة ، إلا أنها لها تأثير داخل الخلايا. تظهر إفرازات Paracrine بدون تأثير أوتوكرين تأثيرًا على الخلايا المجاورة مباشرة.
تشارك بعض خلايا الغدة في الكائن البشري في إفرازات الغدد الصماء والباراكرين في نفس الوقت. مثال على هذه الخلايا هي الخلايا الخلالية Leydig ، والتي تقع في خلالي الخصية. عادةً ما تكمل عمليات إفراز الغدد الصماء والمظاهرة بعضها البعض بدلاً من استبعاد بعضها البعض. لكن لديهم أيضًا خصائص قطبية متبادلة.
تتمثل المهمة الرئيسية لعمليات إفراز الباراكرين في تحفيز وظائف النمو أو عمليات التمايز.
الوظيفة والمهمة
على المدى الطويل ، تتحكم الهرمونات في نمو ووظيفة الخلايا والأنسجة والأعضاء الفردية في جسم الإنسان. في المقابل ، لا يتولى الجهاز العصبي اللاإرادي سوى التحكم في العمليات محدودة الوقت. يقوم النظام الهرموني بمهام دعم الحياة العالمية ، حيث أنه يؤثر على الأعضاء ويتحكم في استقلاب الخلايا والتمايز بين الخلايا الفردية.
يتم تنسيق التأثيرات الفردية لجميع الهرمونات على النحو الأمثل وتنظيم بعضها البعض إلى حد معين عن طريق تثبيط أو تحفيز بعضها البعض. في جسم الإنسان ، فقط هرمونات الأنسجة وما يسمى بالسيتوكينات هي التي تفرز الباراكرين. السيتوكينات هي بروتينات تنظيمية ، أي الببتيدات. قبل كل شيء ، فهي تتحكم في الاستجابة المناعية وتنتجها حالات مختلفة من جهاز المناعة ، مثل الخلايا الليمفاوية.
لا تكون البروتينات المناعية دائمًا باراكرين ، ولكن لها أيضًا تأثيرات على الغدد الصماء. يتوافق تأثيرها paracrine إلى حد كبير مع الشكل الخاص لإفراز المستبد. إن تأثيرات السيتوكينات paracrine ، الأوتوكرين ، والغدد الصماء تشبه الشبكة وتشكل التوازن ، أي توازن للحفاظ على وظائف الأعضاء المعقدة والعمليات الأخرى في الكائن الحي.
بالإضافة إلى السيتوكينات ، يتم إطلاق إفرازات بعض خلايا الغدد الصماء جزئيًا بطريقة paracrine. تفرز خلايا بيتا في البنكرياس وبعض الخلايا في الغدة النخامية الأمامية هرموناتها بالإضافة إلى شكل الغدد الصماء ، على سبيل المثال الباراكرين ، وبالتالي تعمل على الخلايا الموجودة في الجوار المباشر بعد إطلاقها في النسيج الخلالي ، والتي تكون مجهزة بمستقبل للهرمون المعني. اعتمادًا على نوعه وتركيزه ، يطلق الإفراز استجابة محددة بعد الارتباط بالخلايا. يؤدي الجمع بين أشكال الباراكرين والغدد الصماء إلى تغيير تأثير مواد الإشارة المنبعثة.
تتكون أنماط التنظيم في إفراز الباراكرين بشكل أساسي من تثبيط البيئة. تمنع مثل هذه الموانع البيئية الخلايا الموجودة في أنماط الأنسجة المتجاورة مباشرة مع بعضها البعض ، على سبيل المثال ، من التمايز إلى نفس الشكل تمامًا أثناء التمايز.
من ناحية أخرى ، في حالة الشكل المظلي الخاص لإفراز الأوتوكرين ، فإن التغذية الراجعة فائقة القصر هي الآلية التنظيمية الأكثر شهرة. بعد الإفرازات ، ترتبط الإفرازات ببروتينات المستقبل للخلية المفرزة نفسها وبالتالي تمنع إنتاجها.
الامراض والاعتلالات
إذا تم إطلاق عدد قليل جدًا أو كثير جدًا من هرمونات الباراكرين ، فسيكون لذلك تأثير على توازن الهرمونات بالكامل وبالتالي أيضًا على أعضاء أو أنسجة الكائن الحي بسبب التفاعل الوثيق بين مسارات الإفراز.
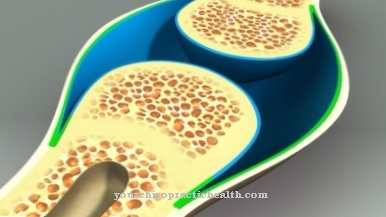
لذلك فإن الأعراض الفردية لاضطراب هرموني أو إفراز متنوعة. يتعامل القسم الطبي لأمراض الغدد الصماء مع الأمراض الهرمونية وبالتالي يضطرب إفراز نظير الباركرين. كقاعدة عامة ، يتعطل النمو والتطور عندما يكون هناك مرض الغدد الصماء أو مرض باراكرين. يمكن لعوامل الباراكرين ، على سبيل المثال ، أن تلعب دورًا مهمًا في تطور هشاشة العظام كما تفعل في خلل التمثيل الغذائي.
واحدة من أهم الاكتشافات هي أهمية عمليات paracrine autocrine في تطور السرطان. على وجه الخصوص ، تلعب عوامل النمو المفرزة دورًا هنا ، والتي تحفز النسيج على النمو في حالة حدوث اضطرابات في سلسلة الإشارات داخل الخلايا. أصبحت الآليات الجزيئية لعمل مواد الباراكرين والأوتوكرين ، ومستقبلات هذه المواد وحلقة التحكم لإفراز عوامل النمو محورًا لأبحاث السرطان في السنوات الأخيرة.
بسبب التحكم في نمو الغدد الصماء ، فإن نمو الورم ، على سبيل المثال ، مستقل عن العوامل الخارجية. لذلك ، فإن التحكم في النمو الذي يتحكم فيه المستبد يقدم نفسه كنقطة انطلاق لعلاج السرطان الحديث. يمكن تقليل تركيز عوامل النمو ، على سبيل المثال ، عن طريق إعطاء الأجسام المضادة وحيدة النسيلة. يُعد حجب المستقبلات المعنية وبالتالي التدخل في عمليات الجسم الأوتوقراطي paracrine خيارًا علاجيًا واعدًا للسرطان.







.jpg)